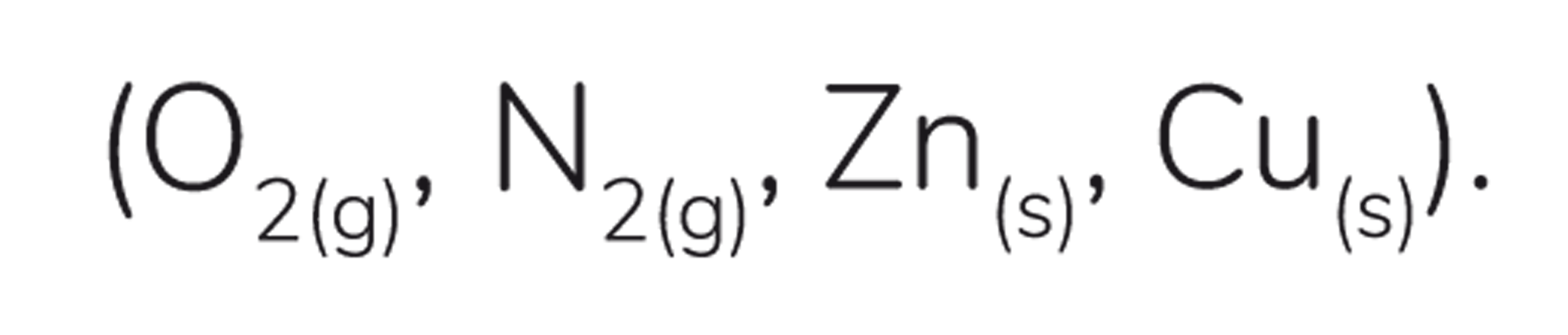Formation/ Réaction d'oxydoréduction
Les réactions d'oxydation sont celles dans lesquelles le transfert d'électrons se produit entre
substances, pas seulement en changeant leurs liants. Dans ces cas, une substance a son indice d'oxydation augmenté et l'autre, a diminué.
Ces réactions sont beaucoup plus fréquentes qu'on ne le pense, et sont bien représentées dans notre vie quotidienne: la formation de rouille, la combustion et même notre respiration sont des réactions d’oxydoréduction (ou réactions redox).
Dans les réactions redox, nous aurons toujours une substance qui perd des électrons, et l'autre qui en reçoit.
La réception d'électrons est appelée réduction. La substance réduite a son nox réduit.
Le don d'électrons est appelé oxydation. La substance oxydée a son nox augmenté.
Pour identifier les réactions redox, nous devons calculer le nombre d'oxydation des réactifs et des produits. Quand on observe que le nox de l'élément est devenu plus positif (électrons perdus), on dit qu'il s'oxyde. Quand le nox d'un élément est devenu plus négatif ou positif plus près de 0, il a diminué.
Voir ci-dessous la réaction de déplacement du cuivre avec du nitrate d'argent. Le nox de cuivre
est passé de 0 à +2: il a perdu deux électrons. Nous disons qu'il s'est oxydé. L'argent est passé de +1 à 0: il a reçu un électron provenant du cuivre. Cette réaction a réduit.
On sait donc que cette réaction est une réaction d'oxydoréduction: l'un des éléments a donné des électrons à un autre.
Ainsi, le cuivre métallique a réagi avec le sel et a subi une simple réaction d'échange. Maintenant,
l'atome Ag est sous sa forme métallique. Par curiosité, cette réaction est connu sous le nom d'arbre d'argent, pour la façon dont les cristaux d'argent se forment - se souvenir des branches d'un pin.
«Arbre» argenté déposé sur une spirale de cuivre et détail microscopique
Point fort: Soyez très prudent avec les concepts d'agent oxydant et réducteur!
Agent Oxydant: Réduit les espèces, provoquant l' Oxydation des autres espèces.
Agent Réducteur: une espèce qui s' Oxyde, provoquant la Réduction des autres espèces.
CALCUL DES NOX
Pour calculer le nombre d'oxydation d'un atome ou d'un ion, il faut suivre quelques règles et procédures simples.
Règles:
1er. Chaque substance a un nombre d'oxydation égal à zéro
2ème. La somme des nombres d'oxydation des éléments d'une espèce chimique neutre
est égal à zéro.
3ème. La somme des nombres d'oxydation des éléments d'une espèce chimique dans la
forme ionique, doit être égale à la charge ionique.
4ème. Les éléments de la famille 1A du tableau périodique montrent le NOX = +1, les éléments de la famille 2A ont le NOX = +2.
5ème. Le NOX de l'oxygène dans la plupart des composés est de -2, sauf lorsqu'il est classé
comme peroxyde de NOX = -1, comme superoxyde de NOX = -1/2 et lorsqu'il est lié au fluor
il vaut +1.
Il existe des éléments qui ont un NOX fixe: les familles 1A et 2A, par exemple, qui ont un NOX fixe+1 et +2, respectivement. L'oxygène contiendra presque toujours du NOX -2. Alors, si nous faisons un système simple, nous pouvons découvrir le NOX inconnu de n'importe quel élément.
Pour les composés neutres, nous savons que la charge totale sera nulle. Donc la charge totale du composé, correspond à 0, en ajoutant son NOX. L'inconnu sera le NOX que nous voulons découvrir.
nous savons que le NOX de Na, faisant partie de la famille 1A sera toujours +1, donc l'oxygène sera presque toujours -2. On peut ainsi déterminer le NOX du phosphore:
Un autre exemple est le
Dans ce cas, notez que l'un des atomes de calcium aura un NOX différent: c'est un oxyde mixte.
Quand nous avons un ion, nous faisons simplement le même système; cependant, la charge complète n'est pas nulle, et par conséquent, nous faisons correspondre le résultat du système à cette charge