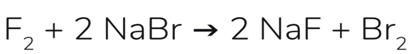Formation: Introduction aux Réactions chimiques
RÉACTIONS CHIMIQUES
Les réactions chimiques se produisent tout le temps dans notre vie quotidienne! Notre métabolisme
est régulé par une série de réactions chimiques en progression constante. Depuis le clin d'œil
des yeux, même notre digestion et notre respiration sont des réactions chimiques.
Lors de la cuisson d'un gâteau, de la combustion d'une allumette ou de la prise d'un comprimé antiacide, nous provoquons des réactions chimiques: les liaisons chimiques d'une substance sont rompues, et des liaisons chimiques de nouvelles substances se forment. En cuisant un gâteau ou en dissolvant un antiacide dans l'eau, on observe la formation de bulles - c'est-à-dire la libération de dioxyde de carbone. C'est pourquoi le gâteau a l'air mignon! Lorsque vous brûlez le phosphore de l'allumette, on peut observer une réaction de combustion, qui outre le dioxyde de carbone, libère également de l'énergie sous forme de lumière et de chaleur.
Exemples de réactions chimiques quotidiennes.
Nous allons apprendre en général comment se déroulent les réactions chimiques.
Nous allons voir également quelques classifications des réactions. Plus tard, nous verrons plus
en particulier certaines réactions chimiques qui nécessitent une attention particulière, telles que
combustion, réactions acide-base et réactions redox, dans le contenu de Thermochimie, équilibre chimique et électrochimie.
Les réactions sont définies comme des processus par lesquels des substances sont transformées
dans d'autres, en rompant et en formant des liaisons chimiques. Comme vous le savez peut-être déjà, les substances qui participent à la réaction chimique sont appelées réactifs, et les substances obtenues après la réaction sont appelées produits.
Nous représentons donc une réaction chimique:
Lorsque des matériaux ayant une certaine affinité chimique entrent en contact, il est probable qu'une réaction se produise. Certaines n'arrivent que dans certaines circonstances (chauffage, présence ou absence de lumière ou d'électricité, etc.), qui sont souvent indiqué dans l'équation chimique, comme nous le verrons plus loin.
Nous allons maintenant étudier les principaux types de réactions chimiques et comment elles peuvent apparaître dans l'examen d'entrée. Il est intéressant de connaître les types les plus courants, afin que vous sachiez identifier généralement et comprendre comment les réactions chimiques se produisent. Il ne suffit pas seulement de mémoriser les réactions chimiques spécifiques produites !
Il faut les comprendre.
RÉACTION OU ADDITION DE SYNTHÈSE
Dans ces réactions, deux substances ou plus, forment un seul produit. Ils ont la forme générale:
Un exemple de ce type de réaction est le magnésium réagissant avec l'oxygène de l'air, produisant
l'oxyde de magnésium:
En général, les réactions entre un métal et un non-métal sont des réactions de synthèse; les métaux ont des électrons à donner et les non-métaux peuvent recevoir ces électrons.
Non seulement les métaux, mais aussi, les non-métaux font des réactions d'addition; la réaction de formation de l'ammoniac (NH3), à partir de deux réactifs, est une réaction d'addition.
Ils peuvent également se produire avec des substances composées, comme la réaction de l'oxyde de
magnésium avec de l'eau, qui produit de l'hydroxyde de magnésium:
En général, les réactions entre un métal et un non-métal sont des réactions de synthèse; les métaux ont des électrons à donner et les non-métaux peuvent recevoir ces électrons.
Non seulement les métaux, mais aussi, les non-métaux font des réactions d'addition; la réaction de formation de l'ammoniac (NH3), à partir de deux réactifs, est une réaction d'addition.
ANALYSE OU RÉACTION DE DÉCOMPOSITION
Lorsqu'une seule substance se décompose, donnant naissance à deux ou plusieurs produits.
Airbags remplis d'azote gazeux.
Un exemple très intéressant de ce type de réaction est ce qui se passe dans les airbags. Quand l'appareil est déclenché, une décomposition rapide s'opère, du composé de sodium NaN3 (s) se dégage du N2 gazeux, qui gonfle les airbags.
La transformation du peroxyde d'hydrogène (H2O2 - peroxyde d'hydrogène) dans l'eau (H2O) et l'oxygène (O2):
La réaction chimique de la levure qui permet au gâteau de gonfler est la même que la réaction du
comprimé antiacide! C'est une réaction de décomposition du bicarbonate de sodium, libérant de l'eau et du dioxyde de carbone:
Décomposition des substances
La décomposition d'une substance chimique est la rupture d'une molécule en ,au moins deux nouvelles substances. Briser une liaison chimique est un processus qui nécessite de l'énergie pour se produire, nous devons donc presque toujours fournir de l'énergie initiale pour que la réaction se produise.
Électrolyse: lorsque l'énergie fournie est sous forme d'électricité.
Photolyse: la substance est décomposée sous l'action de la lumière.
Pyrolyse: dans ces cas, le feu est responsable de la décomposition de la molécule.
Catalyse: en présence de certaines substances, certaines molécules peuvent se décomposer. Par exemple, le peroxyde d'hydrogène se décompose plus facilement lorsque le milieu est alcalin.
RAISON D'UN ÉCHANGE OU DE DÉPLACEMENT SIMPLE
Lorsqu'une substance simple réagit avec un composé, donnant naissance à une nouvelle substance simple et composée.
Réactions d'échange cationique
Lorsqu'une feuille de zinc est introduite dans une solution aqueuse d'acide chlorhydrique,
la formation de chlorure de zinc et d'hydrogène gazeux se produit.
Notez que le zinc a «déplacé» l'hydrogène et que le chlore a eu son ligand «changé». Mais pourquoi
cela arrive-t-il?
Pour répondre à cette question, nous devons nous souvenir de la série de réactivité. Les métaux
les plus réactifs sont les plus électropositifs:
Notez que dans ce cas, nous échangeons un cation (H +) contre un autre (Zn +). Voir que Zn est
plus électropositif que H - par conséquent, il est plus réactif et la réaction peut se produire. C'est l'ordre d’électro-positivité (inverse de l'électro-négativité) consultable dans le tableau périodique.
La réaction entre le disulfure de fer (composé non ionique) et le calcium métallique (atome),
dont les produits sont le fer métallique et le disulfure de calcium (à fort caractère ionique),
correspond également à cette classification:
Notez que le fer est échangé contre du calcium - qui est loin devant le Fer dans l'ordre de réactivité.
Réactions d'échange d'anions
Une autre réaction intéressante est celle du NaBr:
Dans ce cas, nous échangeons des anions: Br - par F-. Pour savoir si la réaction se produit ou pas, nous regardons la série de réactivité anionique - qui est exactement votre électronégativité. Ce qui est le plus susceptible d'être négatif, c'est ce qui restera dans la forme d'anion!
Donc, cette réaction se produit, car le fluor est plus électronégatif que le chlore, et par conséquent,
a une plus grande tendance à rester sous la forme de F-.
La réaction entre le chlore gazeux et l'iodure de sodium serait également possible, car le chlore est
à gauche dans la liste de réactivité et peut déplacer l'iode
RÉACTIONS DE DOUBLE ÉCHANGE
Lorsque deux substances composées réagissent, elles donnent naissance à deux nouvelles substances composées.
Réaction entre le sulfate de cuivre et l'hydroxyde de sodium résultant en un précipité bleu d'hydroxyde cuivre
Sachez que, dans ce cas, il y a eu formation d'Hydroxyde de cuivre solide, qui est insoluble. Comme ces réactions se produisent dans un milieu aqueux, alors le Cu (OH) 2 ne se dissocie pas en Cu2 + et en OH-, les ions de cristaux de sulfure de cuivre ne sont pas en solution pour réagir. Par conséquent, la réaction se produit et est plus favorable. Il se forme du Cu (OH) 2.
Par conséquent, nous devons connaître la solubilité des composés:
Ainsi, chaque fois qu'une réaction forme des composés insolubles, nous savons qu'elle se passe.
Voir d'autres exemples.
La réaction entre l'acide sulfurique et l'hydroxyde de baryum produit de l'eau et du sulfate de baryum.
Le produit sulfate de baryum: BaSO4 (s) est un sel blanc insoluble.
Le chlorure de fer est de couleur jaunâtre. Avec l'ajout d'hydroxyde de sodium, il est devenu brun. Le précipité formé était de l'hydroxyde de fer, qui est insoluble.
Concernant l'état physique des réactifs et des produits:
1. Les réactions homogènes: Celles dans lesquelles le réactif et les produits sont dans le même état physique.
2. Les réactions hétérogènes: Celles dans lesquelles au moins un des réactifs ou l'un des produits sont dans un état physique différent des autres.